Alm. Atom, Fr. Atome, İng. Atom.
Maddenin en küçük ve temel yapı taşı.

Atom, içinde organize tanecikler bulunan ve bunlara bölünebilen yine de maddenin temel yapı taşı olarak bilinen bir birimdir. Bütün maddeleri meydana getiren (madde, boşlukta yer kaplayan ve ağırlığı olan varlık demektir.) 105 çeşit element bilinmektedir. Element, kendisinden başka özellikte maddeler çıkarılmayan saf madde demektir. İşte bu elementlerin her birini meydana getiren en küçük yapı taşları atomlardır. Aynı cins atomlar elementi meydana getirir. Mesela hidrojen ve demir birer elementtir. Çünkü yapılarında birer çeşit atom vardır. Farklı atomların bir araya gelmesinden oluşan maddelere bileşik diyoruz. Su element değil, bir bileşiktir. Oksijen ve hidrojen atomlarından meydana gelmiştir. Su, toprak, ateş, etrafımızdaki bütün maddeler, bu 105 çeşit elementin, yani bunların yapı taşı olan atomların muhtelif şekillerde bir araya gelmesi ile teşekkül etmişlerdir.
Atom teorileri: Rutherford (1911), ince bir maden (altın) levhadan alfa tanecikleri geçirdi. Alfaların çoğu, serbestçe doğru geçip binde biri, yolundan saptı. Madenler atom şebekesi olduğundan, alfaların doğru geçmesi atomların içinin boş olduğunu göstermektedir. Demek ki atomların ortasında, atomun artı elektrik yükünü ve aynı zamanda bütün kütlesini havi bir çekirdek vardır. Bu çekirdeğin çapı atomun tekmil çapından yüz bin defa daha küçüktür. Atomlar elektrikçe nötr olduğu için, çekirdek etrafında, çekirdekteki artı elektrik kadar elektron bulunması lazımdır.
Rutherford, atomları planet modeline benzeterek, elektronların boşlukta gelişigüzel hareket ettiklerini ileri sürdü. Ancak bu model, elektronların yörüngelerindeki ivmeleri dolayısıyla zamanla enerjilerini kayıp ederek, çekirdek üzerine düşmeleri gerekeceği sorusuna cevap veremedi. Bu soruya 1913 yılında Bohr, quanta yörünge modelini geliştirerek cevap verdi. Bohr, elektronların çekirdek çevresinde belirli yörüngelerinin olduğunu ve bir yörüngeden diğerine ganta atlamaları şeklinde geçtiklerini ileri sürdü. De Broglie, Bohr modelinin ortaya koyduğu serbest yörüngeleri, o andaki elektronun madde dalgasının kendi içinde kapalı olarak titreştiği ve böylece duran dalgaların meydana geldiği alanlar olarak açıkladı. Fakat bu madde dalgası fikri ile de atom yapısına fiziksel bir berraklık getirilemedi.
De Broglienin fikirlerinden hareket eden Schrödinger ve Heisenberg (1927) muhtelif matematik ifadelerle modern atom teorisini ortaya koymuşlardı. Bu teoriye göre, elektron için çekirdek etrafında belirli bir yol ve yörünge yoktur. Ancak elektron orbital veya yük bulutu adı verilen alanlarda bulunabilir. Elektronun bulunma ihtimalinin olduğu bölgeler Schrödingerin ortaya koymuş olduğu dalga fonksiyonunun mutlak karesi alınarak bulunabilir.
Bugün bilinen yapıya göre atom, artı elektrik yüküne sahip protonların ve yüksüz nötronların bulunduğu bir çekirdek ile, çekirdek etrafındaki eksi elektrik yüküne sahip elektronlardan meydana gelmiştir. Bir atomdaki proton ve elektron sayıları birbirine eşit olduğunda atom nötrdür. Artı ve eksi yükler arasındaki çekim, elektronları çekirdeğe yakın tutar.
Atomun büyüklüğü: Atomun yarıçapı yaklaşık 10-8 santimetredir. 56 gram demir içinde 6,012.1023= 602.000.000.000.000.000.000.000 tane atom bulunmaktadır. Çekirdeğin yarıçapı 10-13 santimetredir. Yani çekirdeğin çapı atomun çapından 100.000 defa daha küçüktür. Şöyle ki bir atomun içini tamamen çekirdek ile doldurabilmek için 1015 çekirdek gerekir. Büyük bir stadyum ve bunun ortasında bir böcek. Atom ve çekirdeği için böyle bir örnek vermek mümkündür. Böcek atomun çekirdeği ise, elektronların bulunduğu yörüngeler stadyumun duvarlarıdır. Böyle olmasına rağmen atomun hemen hemen bütün kütlesi çekirdekte toplanmıştır. Eğer atomdaki bu büyük boşluk olmasaydı, yani elektronlar bir an için durup dönmeselerdi, dünyamız bir ev kadar küçük olurdu. Bir çay kaşığı su 1015 gr (1 milyar ton) ağırlıkta olacaktı. Böylece kendi vücudumuz dahil olmak üzere, etrafta görebildiğimiz ne varsa hepsinin hemen hemen birer boşluklar aleminden ibaret olduğunu söylemek doğru olacaktır. Atomun insan büyüklüğü yanındaki hacmi, insanın güneş büyüklüğüne nisbeti gibi olup, bu nispet 1028dir. Yani 1028 adet atom bir insanı, 1028 tane insan da güneşi meydana getirir. İnsanın kainattaki yeri güneş büyüklüğü ile atom büyüklüğü ortasındadır.
Proton, nötron, elektron: Önceleri atom, maddenin son durağı bilinirdi. Daha sonra bölünemez sanılan atomda proton, nötron, elektron, mezon, nötrino gibi kütleli veya kütlesiz düzinelerce parçacık keşfedilmiştir. Nötron ve proton atom çekirdeğini teşkil eden parçacıklardır. Kütleleri birbirine yakındır. Protonların kütlesi 1,673.10-24 gram, nötronların ise 1,675.10-24 gram kadardır. Herbirinin kütlesi elektronun 1836 misli kadardır. Nötronlar elektrikçe yüksüz taneciklerdir. Protonlar ise +1 (bir birim pozitif elektrik) yüklüdür. Çekirdekteki proton sayısı kadar +yük mevcut olur. Atomun nötr olması, çekirdek dışındaki elektronların sayısının proton sayısı kadar olmasındandır. Elektronlar, kütlece çok küçük olmalarına rağmen -1 (bir birim negatif elektrik) yüklü olmaları, protonun + yükünü nötrleştiriyor.
Bir atomun çekirdeğindeki proton sayısı atomun numarasını, proton ile nötron sayısı toplamı ise atomun kütlesini verir. Atom numarası aynı zamanda elektron sayısı kadardır. Elektronlar atom çekirdeği etrafında gezegenlerin güneşin etrafında döndüğü gibi dönerler. Nasıl ki güneşe en yakın gezegenin hızı en fazla ise çekirdeğe yakın elektronların hızı da en fazladır. Elektronların çekirdekten uzaklıkları, bir milimetrenin milyonda biri kadardır. Böylece saniyedeki hızları 1000-150.000 km olan elektronlar çekirdek etrafında küçücük yollarında milyarlarca defa dönmektedirler.
Elektron hızında giden bir tren saniyede Haydarpaşadan Erzuruma birkaç kere gidip gelebilir. İşte elektronların bu yüksek hızından dolayı atomların içi dolu gibi görünüyor. Boşluklu olduğu halde, maddelerin içinin dolu sanıldığını, ilk olarak bulan ve kitablarında yazan, başta Mektubat olmak üzere birçok kıymetli kitabların yazarı büyük İslam alimi İmam-ı Rabbani Ahmed Faruki Serhendi hazretleridir.
Atomu organize halde tutan kuvvetler: Atomu gerek kendi içinde muhafaza etmekte, gerekse diğer atomlarla olan hareketlerini düzenlemede dört kuvvet rol oynar. Çekim kuvveti, zayıf kuvvet, elektromanyetik kuvvet ve nükleer kuvvet. Gezegenleri güneş sisteminde tutan kuvvet, çekim kuvvetidir. Aynı tür kuvvet atom ve molekülleri bir arada tutan kuvvettir. Çekirdek etrafında korkunç bir hızla dönen elektronların kaçıp gitmelerini önleyen kuvvet elektromanyetik kuvvettir. Bu kuvvet ters işaretli elektrik yüklerinin birbirini çekmesi şeklinde tezahür eder. Çekirdekte bulunan protonların aynı işarette elektrik yükü ile yüklü bulunmalarına rağmen, birbirlerini itmeyip, bilakis çok yakın durmalarını gerçekleştiren kuvvet nükleer kuvvettir. Bu kuvvetler birbiri ile kıyas edilemiyecek kadar farklı şiddetlerde oldukları halde atomu büyük bir düzen ile kurarlar.
Periyodik sistem: 1867 senesinde Mendelyef ve Lothar Meyer isminde iki kimyager, birbirinden haberi olmadan 105 elementten, o gün bilinenleri, atom ağırlığına göre soldan sağa doğru sıra ile yazmış, birkaç elementten sonra gelenlerin kimya özelliklerinin tekrar baştakilere benzediğini görmüş, bunları baştakilerin altına yazmıştır. Böylece yedi satır meydana gelmiştir. Her satıra devre (periyod) denir. Alt alta olan elementlerin kimyasal özellikleri aynıdır. Bunlara, yukarıdan aşağı, bir grup denir. Yan yana sekiz grup vardır. Yüz beş elementin yedi devir ve sekiz grup teşkil etmek üzere sıralanmasına periyodik sistem (veya devr-i tasnif) denir.
Elektron yörüngeleri: Elementlerde basitten karmaşığa doğru gidildikçe proton sayısı artmakta, dolayısıyla çekirdeğin pozitif elektrik yükü de fazlalaşmaktadır. Elektron sayısının da bu oranda artacağı meydandadır. Nitekim atom numarası 1 olan hidrojenin 1 proton ve 1 elektronu vardır. Atom numarası 2 olan Helyumun 2 proton ve 2 elektronu vardır. 92 numaralı uranyumun 92 protonu ve 92 elektronu vardır.
Bir atomun bütün protonları çekirdekte bulunurken, elektronların atomdaki mevzilenme durumları oldukça komplekstir. Elektronlar çekirdeğin etrafında belli mesafelerdeki yörünge gruplarına belli sayılarla yerleşirler. Her yörünge grubunun elektron kapasitesi bellidir. Yörünge gruplarına elektron zarfı veya tabakası ismi verilir. Elektron zarfları içten dışa doğru K,L,M,N,O,... diye isimlendirilir. Her bir zarfın alabileceği maximum elektron miktarı zarf numarasının karesini iki ile çarpmak suretiyle bulunabilir.
K zarfı: 2 . 12 = 2 elektron
L " : 2 . 22 = 8 "
M " : 2 . 32 = 18 "
N " : 2 . 42 = 32 "
Bu zarflar ayrıca alt yörüngelere ayrılır. Bunlar da içten dışa doğru s,p,d,f harfleri ile temsil edilirler. Bir zarfta bulunan elektronlar bu alt yörüngelere dağılmıştır. Hidrojen atomunun tek elektronu K zarfında, helyum atomunun ikinci elektronu yine K zarfında, Helyum atomunun ikinci elektronu yine K zarfında, lityum ise 3 elektronlu olduğundan, 3üncü elektronu K zarfına sığmayıp, L zarfının ilk yörüngesi sye yerleşir. 6 elektronlu karbon atomunda K ile L zarflarının iki alt zarfı (1s, 2s ile temsil edilirler) ikişer elektron aldığından, kalan iki elektron L zarfının p alt yörüngesine geçer. s,p,d ve f alt zarflarının da maksimum elektron alabilme kapasiteleri sırasıyla 2,6,10 ve 14tür.
Atomların en dıştaki zarfında 8den fazla elektron bulunmaz. Sekizden fazla olanlar bir sonraki zarfa geçer. Mesela potasyumun 19 elektronu vardır. 2si K zarfında, 8i L zarfında bulunur. Geriye kalan 9 elektronu M zarfında yer alabileceği halde, sadece 8i M zarfında kalır, kalan tek elektron N zarfına geçer. Son zarfında 8 elektron bulunan atomlar kararlı atomlardır. Bu yüzden atomlar bu kararlı hale geçmek için ya elektron alma veya verme eğilimi gösterir. İşte bu eğilim yüzbinlerce çeşit bileşiğin teşekkülüne sebeb olur. Mesela sodyumun M zarfında 1 elektronu vardır, klorun ise M zarfında 7 elektronu vardır. Sodyum atomu 1 fazla elektronunu 1 eksik elektronu bulunan klor atomuna verirse, her ikisi de kararlı hale gelir. Bu alışveriş sonucu sodyum atomu elektrikçe nötr halden çıkar, pozitif yüklü bir iyon (katyon), klor ise negatif yüklü bir iyon (anyon) olur. Bu iki zıt yükün çekim kuvveti sonucu sodyum ve klor atomu birleşerek sodyum klorür (NaCl) denilen bileşiği (yemek tuzu) meydana getirirler.
Atom ağırlığı: Bir elementin bir atomunun ağırlığıdır. Mesela 6,02.1023 tane hidrojen atomu 1 gr geldiğinden 1 tek hidrojen atomunun ağırlığı 1/6,02.1023 gr olur. Bu rakam oldukça küçük olduğundan genellikle Avagadro sayısı (1 mol) kadar atomun ağırlığından söz edilir. Böylece 1 mol Fe atomu 56 gr, 1 mol oksijen atomu 16 gr olur.
Atom kütlesi: Bir kimyasal elementin atomlarının ortalama kütlesinin standart bir kütleye oranıdır. Söz konusu standart kütle 1961'de karbon-12 izotopunun bir atomunun kütlesinin 1/12'si olarak seçilmiştir. Buna atomik kütle birimi (akb) denir. Böylece hidrojenin atom kütlesi 1, oksijenin atom kütlesi 16 ve demirin atom kütlesi 56 olur.
Atom numarası: Elementlerin çekirdeklerindeki proton sayısına göre küçükten büyüğe doğru sıralandıkları periyodik tabloda, her elementin sıra numarası. Yüksüz bir atomda elektronların sayısı protonların sayısına eşit olup, bu sayı atom numarasıdır. Mesela, 7 protonu bulunan azotun atom numarası 7, 8 protonu bulunan oksijenin atom numarası 8'dir.
Atom Modelleri: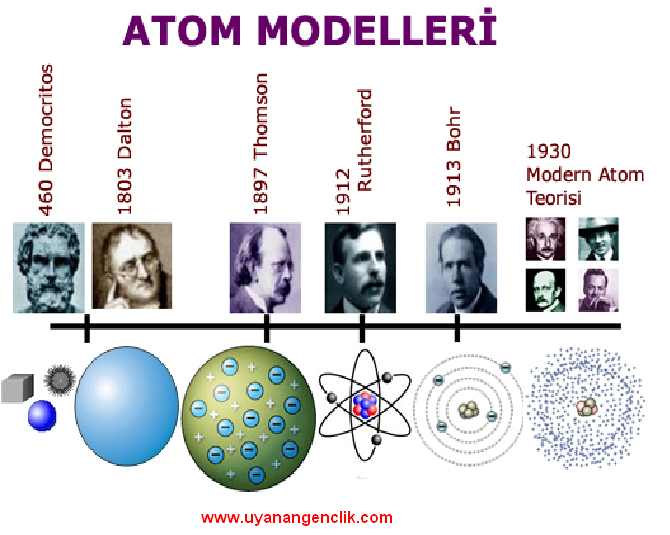

Daltona göre atomlar, içleri dolu ve parçalanamayan berk kürelere benzemektedir.
1897 yılında Joseph John Thomson (Jozef Con Tamsın), atomun daha küçük parçacıklardan oluştuğunu buldu. Atomu üzümlü keke benzettiği bir modelle açıkladı.

Bu modeldeki keki pozitif yüklere, üzümleri ise negatif yüklere benzetti.
Bu sayede atomun parçalanamadığı fikrini çürüttü.

Thomson atom modelinde protonların ve elektronların rastgele mi yoksa belli bir düzene göre mi durduklarını araştırmak için deneyler yaptı ve deneylerinin sonucunda pozitif yüklere proton, pozitif yükün bulunduğu kısma ise, çekirdek adını verdi. Elektronların ise çekirdeğin çevresinde gezegenlerin Güneş çevresinde dolandığı gibi döndüklerini söyledi.
Bunun sebebi olarak da çekirdekle elektronlar arasında çekim kuvveti olduğunu ve elektronların çekirdeğe düşmemeleri için tek çare çekirdeğin çevresinde dönmeleri gerektiğini ifade etmiştir. Geliştirdiği bu atom modeliyle Nobel kimya ödülünü kazanmıştır.
Niels Bohr (Nil Bor)da elektronların çekirdeğin çevresinde rastgele dönmediğini, çekirdeğe belirli uzaklıklardaki katmanlarda döndüğünü ifade etmiştir. Bu açıklama sıyla Nobel fizik ödülü kazanmıştır.

Niels Bohr (Nil Bor)da elektronların çekirdeğin çevresinde rastgele dönmediğini, çekirdeğe belirli uzaklıklardaki katmanlarda döndüğünü ifade etmiştir.
Bu açıklama sıyla Nobel fizik ödülü kazanmıştır.