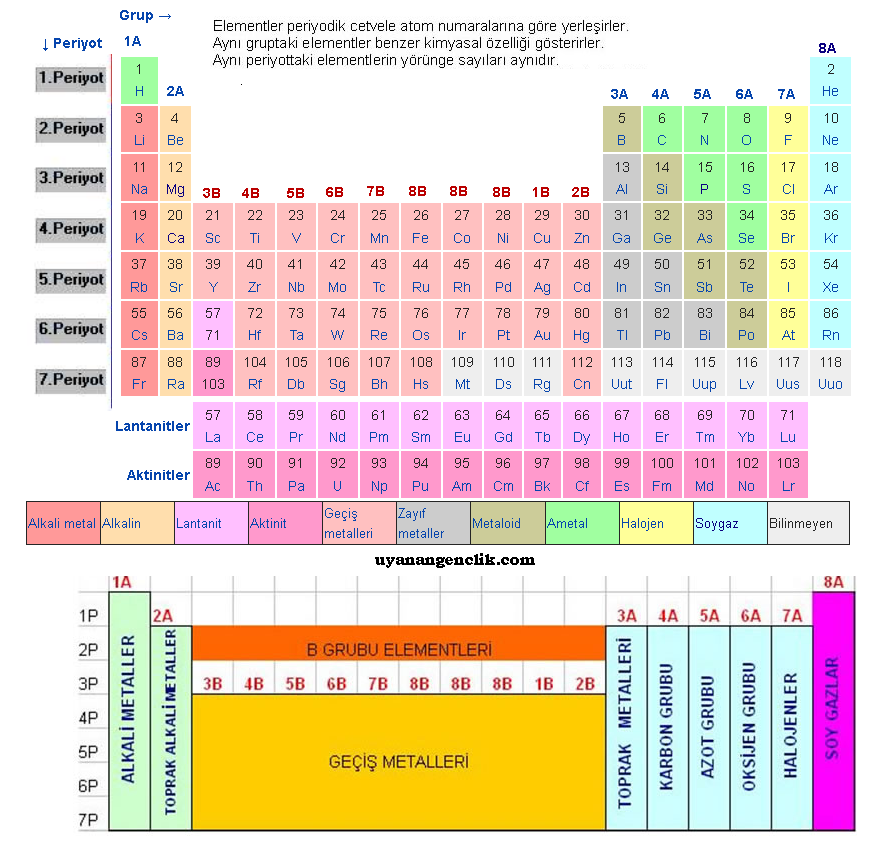
PERİYOTLAR CETVELİ Elementlerin sembolleriyle gösterildiği ve özellikleri hakkında bilgi veren cetveldir
Periyotlar cetveli ilk defa dimitri
Mendelev tarafından yapılmıştır(elementleri atom ağırlıkları=Kütlelerine göre düzenlemiştir.

Periyotlar cetveli yatay ve düşey sıralardan oluşmuştur
PERİYOT Periyotlar cetvelindeki yatay sıralardır
Elementler atom numarası en küçük ten en büyüğe doğru ( soldan sağa ) sıralanırlar
Periyot numarası enerji seviyesini = yörünge sayısını gösterir
7 periyot bulunur
PERİYOTLAR CETVELİNDE SOLDAN SAĞA DOĞRU GİDİLDİKCE 1- Atom numarası artar
2- Kütle numarası artar
3- Metalik özellik azalır
4- Ametalik özellik artar
5- Elektron verme özelliği azalır
6- Elektron alma özelliği artar
7- Atom çapı küçülür
8- Asitlik özelliği artar
9- İyonlaşma enerjisi büyür
10- Elektro negatiflik büyür
LANTANİTLER : Atom numarası 58 71 olan elementler ( 6 periyotta )
AKTİNİTLER : Atom numarası 89 - 1 0 3 olan elementler ( 7 periyotta )
1. Periyotta 2 element
2 . 8
3 . 8
4 . 18
5 . 18
6 . 32
7 . 23 tamamlanmamıştır
GRUP Periyotlar cetvelindeki düşey sıralardır
Elementler gruplara ortak kimyasal özelliklerine göre sıralanmıştır
18 tane grup vardır
8 tane A grubu
8 tane B grubu ( 8B grubu 3 gruptan oluşur )
1A Grubu ALKALİ METALLER
2A TOPRAK ALKALİ METALLER
3A METALLER
7A HALOJENLER
8A SOYGAZLAR
1A , 2A , ,3A , grubunda
METALLER
4A , 5A , 6A , 7A grubunda
AMETALLER
8A grubunda
SOYGAZLAR
PERİYOTLAR CETVLİNDE YUKARIDAN AŞAGIYA DOĞRU İNİLDİKÇE 1- Atom numarası artar
2- Kütle numarası artar
3- Metalik özellik artar
4- Ametalik özellik azalır
5- Elektron verme isteği artar
6- Elektron alma isteği azalır
7- Atom çapı büyür
8- Bazlık özelliği artar
Her grup ve periyot boyunca elementlerin özellikleri genellikle sistematik bir biçimde değişiklik gösterirler.
Aynı grupta olan elementler sertlik, parlaklık, iletkenlik, elektron alma veya verme yatkınlıları bakımından birbirine benzerdir.
METALLER 1- Katıdırlar ( Civa = Hg hariç )
2- Yüzeyleri parlaktır
3- Isı ve elektriği iyi iletirler
4- Tel ve levha haline gelebilirler
5- Tek atomludurlar ( atomik yapılıdırlar )
6- Kendi aralarında bileşik yapmazlar
7- Kendi aralarında alaşım yaparlar
8- Elektron verme özelliğindedirler ( katyon = +)
9- Ametallerle iyonik bileşik yaparlar
10- Canlıların yapısında çok az bulunur
11- Erime-kaynama noktaları yüksektir
12- 1A,2A,3A grubunda bulunurlar
13- Sulu çözeltileri BAZ özelliği taşır
Metaller ;- periyodik tablonun sol tarafında bulunurlar.
- genellikle dayanıklı ağır , parlak maddeler olarak tanımlanır.
- ısı ve elektriği iyi iletirler.
- dövülerek tel ve levha haline getirilebilirler.
- üzerine vurulduğunda çınlama sesi duyulur.
A METALLER 1 - katı, sıvı, gaz halindedirler
( İyot=I , karbon=C , fosfor = P , kükürt = S katı )
( Brom= Br sıvı )
( Azot=N , Oksijen=O, Hidrojen=H klor=Cl gaz )
2 - Yüzeyleri mattır
3- Isı ve elektriği iyi iletmezler
4- Tel ve levha haline gelemezler
5- İki ve daha fazla atomludurlar ( molekül yapılı
6- Kendi aralarında bileşik yaparlar
7- Kendi aralarında alaşım yapmazlar
8- Elektron alma özelliğindedirler ( Anyon= - )
9- Kendi aralarında Kovalent bileşik yaparlar
10- Canlıların yapısında bolca bulunurlar
11- Erime-kaynama noktaları düşüktür
12- 4A,5A,6A,7A grubunda bulunurlar
13- Sulu çözeltileri ASİT özelliği taşır
Ametaller ;- periyodik tablonun sağ tarafında bulunurlar.
- genellikle parlak olmayan ( mat ) maddeler olarak tanımlanır.
- ısı ve elektriği iyi iletmez.
- dövülerek tel ve levha haline getirilemezler kırılgan yapıdadırlar.
- ametaller ve bileşikleri değişik alanlarda kullanılırlar.
Örnek : Klor ve bileşikleri ;
Kuru temizlemede kirlerin çözünmesinde,
Yüzme havuzlarının bakterilerden arındırılmasında,
Tuvalet temizliğinde ,
Hidroklorik asit yapımında ,
Tarımda yabani otların temizlenmesinde,
İçme sularının bakterilerden arındırılmasında,
Antiseptik ve dezenfektan olarak kullanılan ilaçların yapımında
YARI METALLER Hem metallerin hem de ametallerin özelliklerini bir arada taşıyan elementlere denir.
Yarı metaller bazı fiziksel özellikleri ve görünüşleri yönünden metallere , kimyasal özellikleri bakımından daha çok ametallere benzerler.
Yarı metaller sınıfında 8 element bulunurBor = B Silisyum = Si Germanyum = Ge Arsenik = As
Antimon = Sb Tellür = Te Polanyum = Po Astanit = At
1 Parlak veye mat olabilirler
2 - Elektrik ve ısıyı ametallerden daha iyi metallerden daha az iletirler.
3 - İşlenebilirler ( tel ve levha haline getirilebilirler )
4 - Kırılgan değildirler.
Yarı metaller- elektronik devre elemanlarında ,
- değişik alanlarda ( mikroskop mercekleri , projektörlerde ) kullanılır.
SOY GAZLAR 1- Doğada gaz halinde bulunurlar
2- Kararlı yapıdadırlar
3- Bileşik oluşturmazlar
4- Tek atomludurlar
5- Erime kaynama noktaları düşüktür
6- Periyodik tabloda 8A grubunda yer alırlar
Helyum = He Argon = Ar Ksenon = Xe
Neon = Ne Kripton = Kr Radon = Rn
8A: Hergele Necip Arsız Karsını Xesti, Rendeledi.